Le Pancréas artificiel de Medtronic sera commercialisé aux États-Unis en 2017
Le 28 septembre 2016, la FDA (Agence américaine des produits alimentaires et médicamenteux) a autorisé la commercialisation du pancréas artificiel Medtronic Minimed 670G. C’est la première fois qu’un pancréas artificiel sera commercialisé dans le monde.
Jeffrey Shuren MD, JD, directeur de la FDA Center for Devices and Radiological Health, indique que cette nouvelle technologie peut apporter aux gens atteints de diabète de type 1 une plus grande liberté de vivre leur vie. Ils n’auront plus à surveiller constamment et manuellement leur taux de sucre dans le sang et à s’injecter de l’insuline.
MiniMed 670G comment ça marche ?
Comme son homologue français Diabeloop, le Medtronic MiniMed 670G est un système à boucle fermée. Souvent désigné comme un «pancréas artificiel», il est destiné à ajuster les niveaux d’insuline avec peu ou sans intervention de l’utilisateur. Il fonctionne en mesurant les niveaux de glucose toutes les cinq minutes et administre ou non de l’insuline automatiquement. Le système comprend un capteur qui se fixe sur le corps pour mesurer les niveaux de glucose, d’une pompe ainsi que d’un patch relié à la pompe par un cathéter qui délivre de l’insuline.
Ce pancréas artificiel est destiné à surveiller automatiquement le glucose et fournir les doses d’insuline appropriées chez les personnes de 14 ans et plus atteintes de diabète type 1.
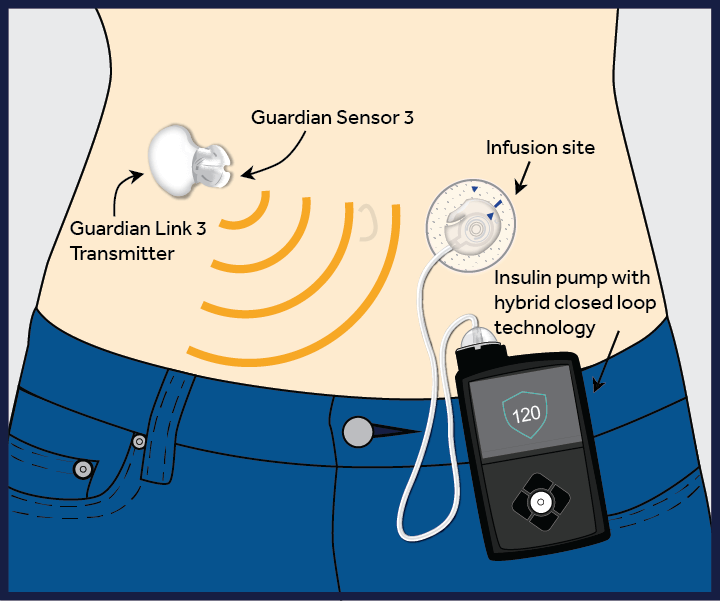
schéma du pancréas artificiel Medtronic
Un essai clinique satisfaisant
La FDA a évalué les données d’un essai clinique avec 123 participants atteints de diabète de type 1. L’essai a inclus une période initiale de deux semaines sans utilisation du MiniMed 670G suivie d’une étude de trois mois au cours de laquelle les participants ont utilisé le MiniMed 670G. Cet essai clinique a montré que le dispositif est sûr pour une utilisation chez les personnes de 14 ans et plus atteintes de diabète type 1. Aucun événement indésirable grave, comme l’acidocétose diabétique ou l’hypoglycémie sévère, n’a été signalé au cours de l’étude.
« Dans le cadre de notre engagement à améliorer les soins du diabète, la FDA a travaillé de manière interactive avec Medtronic dès les premiers stades de développement pour aider à rendre cette technologie disponible pour les personnes atteintes de diabète de type 1 le plus rapidement possible. Nous encourageons les entreprises à travailler en étroite collaboration avec l’agence pendant la conception de nouveaux modèles d’étude. Cela permet d’accélérer l’évaluation de la FDA et l’approbation ultérieure de nouveaux dispositifs qui peuvent faire une différence pour les patients. » – Alberto Gutierrez, Ph.D. , directeur du Bureau du diagnostic in vitro et la santé radiologique dans le Centre de la FDA pour les dispositifs et la santé radiologique.
Le pancréas artificiel et ses risques
Les risques associés à l’utilisation du système peuvent inclure l’hypoglycémie, l’hyperglycémie, ainsi que l’irritation de la peau ou des rougeurs autour du patch de perfusion de l’appareil. Cette version ne convient pas pour une utilisation chez les enfants de 6 ans ou plus jeunes. Elle n’est pas appropriée non plus pour les patients qui ont besoin de moins de huit unités d’insuline par jour.
Des études supplémentaires sont demandées par la FDA
Dans le cadre de cette approbation, la FDA exige une étude post-commercialisation afin de mieux appréhender l’utilisation de l’appareil dans la vie de tous les jours. Alors que le dispositif est approuvé aujourd’hui pour une utilisation chez les personnes de 14 ans et plus avec le diabète de type 1, Medtronic procède actuellement à des études cliniques pour évaluer l’innocuité et l’efficacité du dispositif chez les enfants diabétiques âgés de 7 à 13 ans.