Un élément perturbateur comme un changement d’alimentation, et c’est toute la flore intestinale qui se dérègle avec des répercussions possibles sur la santé. Une étude internationale de recherche, menée par l’unité de Pathogénie microbienne moléculaire (Institut Pasteur/Inserm) dirigée par Philippe Sansonetti, vient notamment de mettre en évidence, chez la souris, l’influence directe d’une alimentation trop riche en graisse sur la flore intestinale et son environnement. Face à ce nouveau régime, les communautés de bactéries se réorganisent et le petit intestin lui-même se métamorphose. Et ce, dès le premier mois. Ces résultats ont été publiés dans la revue PNAS, le 16 septembre 2016.
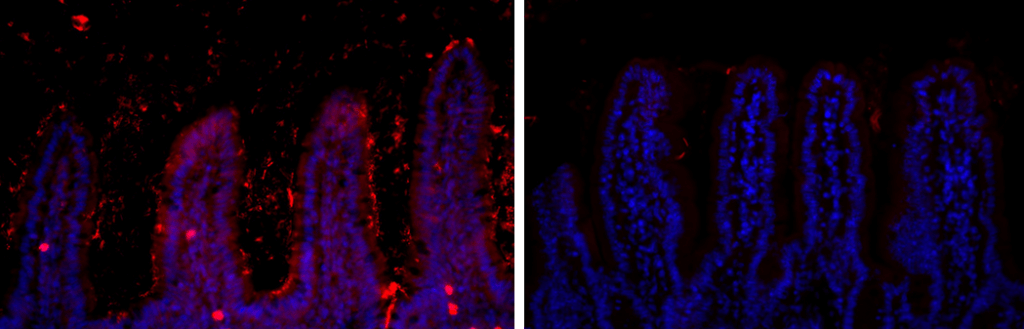
Localisation des bactéries dans l’iléum de souris soumises à un régime standard (image de gauche) ou à un régime riche en graisse (image de droite). © Institut Pasteur
Les milliards de bactéries qui peuplent notre intestin – et qu’on appelle le microbiote – jouent un rôle central dans la digestion mais aussi dans certaines maladies comme le diabète de type 2 ou l’obésité. Ces pathologies ont souvent été associées à un déséquilibre de la flore intestinale, certaines bactéries devenant clairement prédominantes, et à un intestin perméable, susceptible de libérer dans le sang des substances inflammatoires. Mais si de nombreuses études se sont intéressées à l’état du microbiote intestinal une fois la pathologie installée, très peu se sont focalisées sur l’installation de ce déséquilibre intestinal lors de l’introduction d’une alimentation riche en graisse par exemple. C’est pourquoi une équipe internationale de recherche s’est penchée sur la question. « Nous voulions voir, de façon précoce, comment se comportaient les bactéries intestinales face à un régime riche en gras, souligne Thierry Pédron, ingénieur de recherche dans l’unité de Pathogénie microbienne moléculaire (Institut Pasteur/Inserm). Et rapidement, nous avons concentré nos recherches sur l’intestin grêle car c’est là que nous avons observé les variations les plus flagrantes ! ».
Certaines souris de l’étude ont donc reçu une alimentation ordinaire tandis que d’autres recevaient une alimentation composée à 70 % de lipides. Grâce à des techniques de génomique, les chercheurs ont pu identifier les différentes espèces bactériennes contenues dans des échantillons de fèces et suivre l’évolution de la composition du microbiote au cours du temps. Ils ont également localisé et identifié avec précision les bactéries au sein de l’intestin grêle.
« Un mois seulement après le début de Communiqué de presse ce nouveau régime riche en graisse, nous avons constaté des changements dans la composition du microbiote, présente Thierry Pédron. Certaines espèces bactériennes proliféraient tandis que d’autres diminuaient, l’espèce Candidatus arthromitus ayant même complément disparu. Par ailleurs, et de façon totalement inédite, nous avons observé une concentration massive des bactéries entre les villosités de l’épithélium intestinal ».
D’ordinaire, les bactéries ne peuvent pas se rapprocher ni même traverser la paroi intestinale car l’épithélium libère des peptides antimicrobiens et il est tapissé d’un mucus protecteur. Les chercheurs se sont alors intéressés à ces défenseurs de la paroi intestinale : ils ont constaté que la production de peptides antimicrobiens chutait suite à une ingestion massive de lipides et que la couche de mucus s’affinait. Autrement dit, non seulement le microbiote se réorganise sous l’influence des lipides mais l’intestin, lui-même, subit des métamorphoses. Et les modifications ne s’arrêtent pas là. Des mesures complémentaires ont permis de mettre en évidence une augmentation de la perméabilité de l’intestin grêle et une diminution de l’activité de PPAR-γ. « PPAR-γ est une molécule qui a de nombreuses fonctions, elle joue un rôle important dans le métabolisme des acide gras, mais aussi dans l’inflammation et le développement embryonnaire, explique Thierry Pédron. Cette chute semble intimement liée à celle des peptides antimicrobiens. » Et si les liens entre tous ces résultats, et leurs implications potentielles dans certains déséquilibres alimentaires, ne sont pas encore établis, il est rassurant de noter que lorsque les souris retrouve un régime alimentaire équilibré, tout rentre dans l’ordre au bout d’un mois !
Sources
High-fat diet modifies the PPAR-γ pathway leading to disruption of microbial and physiological ecosystem in murine small intestine, PNAS, 16 septembre 2016. DOI : 10.1073/pnas.1612559113
Unité de Pathogénie Microbienne Moléculaire, INSERM Unit U1202, Institut Pasteur, 75724 Paris Cedex 15, France; [Julie Tomas, Céline Mulet, Azadeh Saffarian, Philippe J. Sansonetti, Thierry Pédron]
Institut National de la Recherche Agronomique, UMR 1319 MICALIS, F-78350 Jouy-en-Josas, France; [Julie Tomas]
AgroParisTech, UMR 1319 MICALIS, F-78350 Jouy-en-Josas, France; [Julie Tomas]
INSERM UMRS 1149, Centre de Recherche sur l’inflammation, Unité de Formation et de Recherche de Medecine Paris Diderot, F-75018 Paris, France; [Jean-Baptiste Cavin, Robert Ducroc]
Plate-forme de Génotypage des Eucaryotes, Biomics Pole, Centre d’Innovation et Recherche Technologique,
Institut Pasteur, Paris F-75015, France; [Béatrice Regnault]
Lee Kong Chian School of Medicine,Nanyang Technological University, Singapore; [Chek Kun Tan, Kalina Duszka, Walter Wahli]
Institut des Maladies Métaboliques et Cardiovasculaires, INSERM U1048 F-31432 Toulouse, France; [Rémy Burcelin]
Université Paul Sabatier, F-31432 Toulouse, France; [Rémy Burcelin]
Center for Integrative Genomics, University of Lausanne, 1015 Lausanne, Switzerland; and [Walter Wahli]
Chaire de Microbiologie et Maladies Infectieuses, Collège de France, 75005 Paris, France [Philippe J. Sansonetti]